DETERIORO COGNITIVO LEVE
En las últimas décadas el concepto de la Enfermedad de Alzheimer (EA) ha ido cambiando. Al principio se definía como una entidad clínico-patológica, donde el diagnóstico de certeza se establecía mediante autopsia (McKhann G et al, 1984). En la actualidad se considera una entidad definida por una biología característica que puede constatarse con el paciente en vida, mediante la existencia de una proteinopatía dual: amiloidopatía más taupatía (Jack CR et al, 2018).
Desde hace más de una década, se ha intentado realizar un diagnóstico de la EA en las fases iniciales. Así, desde 2007, los diferentes criterios diagnósticos de consenso internacional ( IWG-1, 2007; NIA-AA, 2011; IWG-2, 2014; NIA-AA, 2018) (Dubois B et al, 2007; Albert Ms et al, 2011; Dubois B et al, 2014; Jack CR et al, 2018) han tenido como objetivo definir la fase prodrómica de la enfermedad (EA prodrómica) o Deterioro Cognitivo Leve (DCL). Estos criterios se basan en dos premisas: la primera es la detección de la característica pérdida de memoria, de tipo hipocampal (IWG-1, 2007; IWG-2, 2014), y la segunda es la positividad de biomarcadores de amiloidopatía (PET amiloide positivo; reducción de Aβ42 en LCR) y taupatía (PET tau positivo; aumento de P-tau en LCR) (IWG-2, NIA-AA, 2014; NIA-AA, 2018).
El DCL, definido según criterios clínicos (Albert et al., 2011), es la afectación de uno o más dominios entre los cuales se encuentran principalmente la memoria episódica, el lenguaje, las capacidades visuoespaciales, visuoperceptivas y ejecutivas, junto por último, a cambios en el comportamiento del sujeto. Se diferencia el DCL de la demencia en la independencia funcional que mantiene el sujeto.
El DCL no es su síntoma exclusivo de las enfermedades neurodegenerativas ya que puede acontecer en otras enfermedades neurológicas así como sistémicas. Debido al funcionamiento complejo del cerebro una lesión en una estructura de este órgano, o el daño en estructuras cercanas (cerebelo o tronco del encéfalo) puede afectar a una o varias funciones cognitivas.

Figura 1. Esquema de evolución de la enfermedad.
En ocasiones, los primeros síntomas que presenta el paciente son tan sutiles que pueden no ser detectados por las pruebas neuropsicológicas habituales, esto es deterioro cognitivo subjetivo. Es importante en estos pacientes, que además de adecuar la valoración neupsicológica a su edad y nivel educativo, se tengan en cuenta posibles factores que estén influyendo (reserva cognitiva, fármacos, trastornos del ánimo y del sueño). En estas ocasiones además de una exploración inicial, es aconsejable completar el estudio básico con analítica y neuroimágen, así como un seguimiento del paciente.
El DCL se divide clásicamente en dos tipos amnésico o no amnésico (también denominado atípico). Y a su vez en función de los dominios afectos: monodominio o multidominio (Patersen et al, 2004). Esta clasificación podía orientarnos a una etiologia, como es el caso de la enfermedad Alzheimer en el DCL amnésico. En 2011, (Albert el al, 2011) gracias a la introducción de los biomarcadores conocimos de forma certera y precoz el diagnóstico definitivo de la enfermedad. A día de hoy existen criterios diagnósticos para enfermedades que asocian deterioro cognitivo como es el caso de la enfermedad de Cuerpos de Lewy, el deterioro cognitivo asociado a la enfermedad de Parkinson, o las afasias progresivas primarias, pero no siempre asocian el uso de biomarcadores.
Para el diagnóstico del DCL debido a una patología neurodegenerativa primaria que es lo que trataremos aquí, es necesario no solo objetivar la afectación del dominio/s, si no también descartar mediante neuroimagen y análisis sanguíneo que no sea debido a una causa secundaria.
La exploración se compone de una parte física donde buscaremos si existen síntomas parkinsonianos (como temblor de reposo, bradicinesia, rigidez en rueda lenta, alteración en los movimientos oculares, trastorno de la marcha), piramidalismo (reflejos miotáticos exaltados, respuesta cutáneo plantar extensora..) o menos frecuentes como los síntomas cerebelosos (ataxia de la marcha, dismetría apendicular…)
En la exploración de un paciente con sospecha de DCL debemos ayudarnos de protocolos donde estudiemos de forma ordenada los dominios establecidos: lenguaje, funciones ejecutivas, visuespacial-visuoperceptivo, memoria episódica y conducta. Una buena exploración debe ser lo más completa posible, sin llegar a extenuar al paciente. Debemos saber que ningún test evalúa de forma pura un solo dominio. Se recomienda comenzar la exploración con un test de screening global, para conocer en un primer momento, cuales son los principales dominios afectados, y así posteriormente orientar la valoración neuropsicológica. Entre los test neuropsicológicos abreviados de screening más usados en la práctica clínica para la evaluación del deterioro cognitivo se encuentra el Mini-Mental State Examination (MMSE), cuya puntuación máxima es 30. El punto de corte mas usado para determinar el DCL suele ser inferior o igual a 24 puntos ( De Beaman et al., 2004).
Para valorar la memoria episódica, el test más usado tradicionalmente ha sido el Free and Cued Selective Reminding Test (FCSRT), cuya duración media de realización suele ser de unos quince minutos, tanto en su forma pictórica como verbal (Grande G et al., 2018).
Desde 2017 disponemos de un test que valora la memoria visual asociativa (Maillet D el al, 2017), que requiere escasos minutos de realización. Se evalúa la memoria visual asociativa mediante figuras que se relacionan semánticamente (Figura 2-ver video). El tiempo de administración en personas sanas es de 2,2 min [rango intercuartílico (IQ)=2], en pacientes con DCL de 6,3 min [IQ=3,1] y de 7,6 min [IQ=3,6] en sujetos con demencia leve. Se ha demostrado que existe una buena confiabilidad interobservador (Coeficiente de Correlación Intraclase de 0,999 [CI95%=0,99-1]) (Franco-Macías E et al., 2020). Esta validado hasta en adultos mayores de 75 años (Rodrigo-Herrero S et al., 2020) (Figura 3). Además, se ha comparado con FCSRT, siendo tan válido como este en la detección de DCL amnésico, incluso en individuos con bajo nivel educativo (Rodrigo-Herrero S et al., 2021).
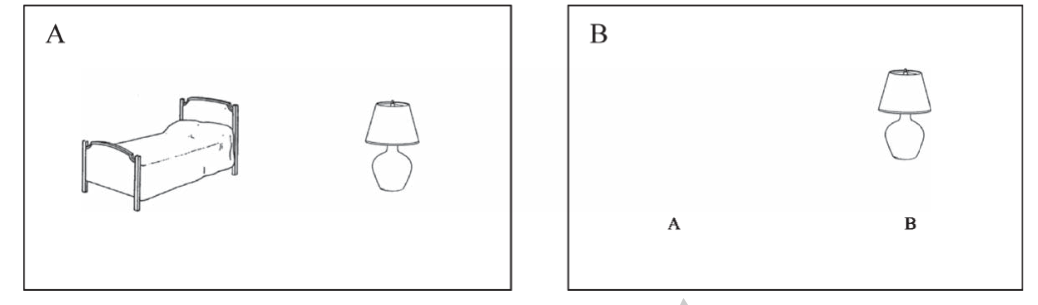
Figura 2. Ejemplo de dibujo TMA-93. A) Fase de codificación B) Fase de recuperación.
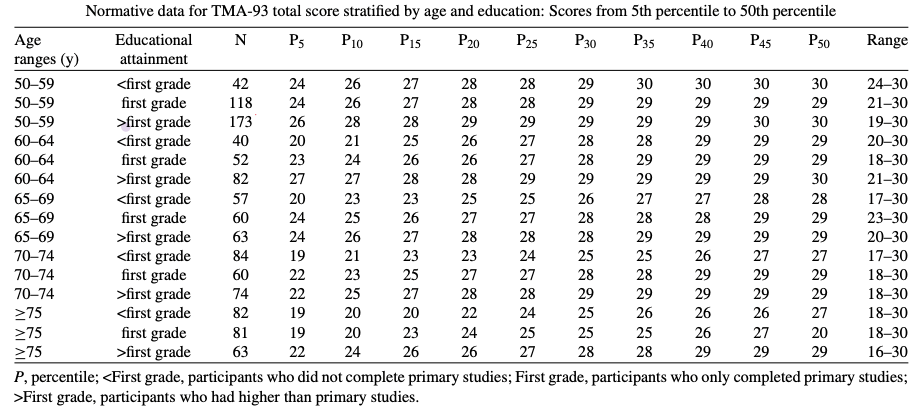
Figura 3. Valores obtenidos tras estudio normativo del test en la población española. Se suele tomar como punto de corte el percentil 10. ( Rodrigo-Herrero S et al., 2020)
Como hemos comentado, dentro de la valoración es necesario una prueba de neuroimagen. A día de hoy las que disponemos son TAC craneal y Resonancia Magnética (RM) craneal, siendo esta última la que más información nos puede dar.
La RM craneal nos permite estudiar la localización de la atrofia, así como las lesiones vasculares asociadas. La atrofia del hipocampo situado dentro del lóbulo temporal medial, es el biomarcador mas robusto a nivel de neuroimagen no solamente en EA. Se puede medir por escalas visuales (Scheltens et al., 2002). Los estudios mediante morfometría por voxel han demostrado que existe una reducción de la materia gris tanto en el lóbulo mesial temporal, corteza cingulada posterior y precuneus (Hamalainen A et al, 2007).
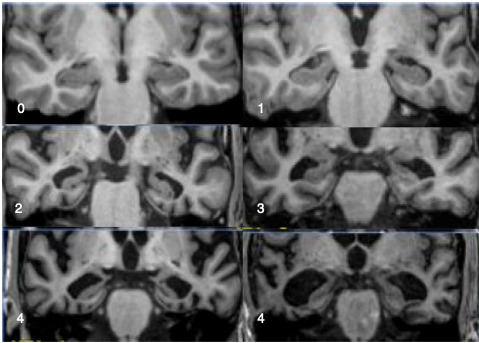
Figura 4. Escala de atrofia temporal medial de Scheltens. 0: no hay atrofia;1: ampliación de la cisura coroidea; 2: ampliación del asta temporal; 3: disminución moderada de la altura del hipocampo; 4: disminución marcada de la altura del hipocampo. (Alvarez Lineda-Prado J et al., 2018).
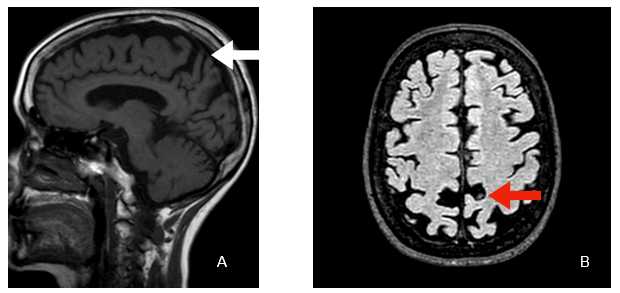
Figura 5. Imagen A: corte sagital en T1 atrofia de cinglo posterior (flecha). Imagen B: Corte axial-FLAIR atrofia de precuneus ( flecha).
La tomografía computarizada por emisión de fotón único ( SPECT- tecnecio-99m-hexametil propileno amina oxima) y la tomografía por emisión de positrones (PET-18F-FDG), proporcionan información a nivel funcional. Numerosos estudios tanto con PET-18 F-FDG y SPECT en pacientes con EA han documentado patrones específicos de hipometabolismo e hipoperfusión en la corteza cingulada posterior y el precuneus en estadios prodrómicos, siendo mas sensible y especifico el PET-18F-FDG (Valotassiou V et al., 2015).
Gracias a los avances de los últimos años, la medicina nuclear de la actualidad va mas allá de la evaluación de la perfusión cerebral y el metabolismo de la glucosa. Existen ya radiofármacos que son capaces de detectar depósitos de A-Beta amiloide, dando información molecular. Concentraciones en el LCR de Ab-42 se correlacionan negativamente con la retención de amiloide en el PET, por tanto el PET amiloide con la detección de Ab-42 junto a T-tau y P-Tau en el LCR pueden ser buenos marcadores en el diagnóstico de la EA.
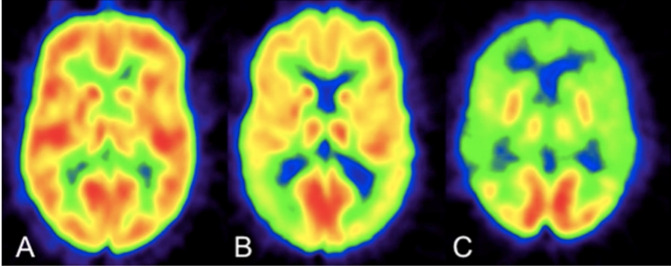
Figura 6. PET-FDG. Imagen A corresponde a un sujeto sano, actividad adecuada a nivel cortical y en ganglios basales. Imagen B corresponde a un sujeto con DCL, se observa una reducción del metabolismo a nivel parietal bilateral, así como a nivel frontotemporal y ganglios basales. Imagen C pertenece a un paciente con EA evolucionada, existiendo disminución marcada de la actividad de forma generalizada. (Rice L et al., 2017).
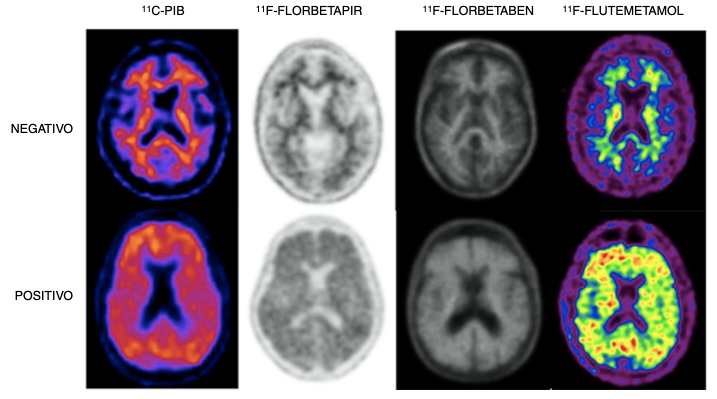
Figura 7. PET amiloide. Imágenes PET positivas (abajo) y PET negativas (arriba), para placas AB realizadas con diferentes radiofármacos. (Camacho V et al., 2018).
La proteína que primero fue identificada fue T-tau (Blennow et al., 2003), que se eleva en estadios iniciales de procesos neurodegenerativos, como bien se ha estudiado en la EA de inicio (Mattsson et al., 2009), y es reflejo de la degeneración neuronal. Sin embargo la P-Tau se relaciona con la formación del ovillo neurofibrilar y la Ab-42 con la carga de amiloide a nivel cerebral. Niveles elevados de P-Tau en el LCR se correlacionan con una progresión más rápida de la enfermedad, por lo tanto es un buen marcador de conversión al estado de demencia (Brys et al., 2009). Los niveles Ab-42 en el LCR se correlacionan inversamente con el recuento de la Ab-42 de las placas depositadas a nivel cerebral. Por lo tanto un nivel bajo de Ab-42 en LCR indica que la mayor retención de ésta proteína es a nivel cerebral (Blennow et al., 2010). Ninguno de estos marcadores, de forma aislada es suficiente para llegar al diagnóstico. Por tanto, la conjunción de niveles bajos de Ab-42 y altos tantos de T-Tau y P-Tau, aumentan significativamente la precisión para el diagnóstico, incluso en estadios prodrómicos (sensibilidad de 90 a 95% y especificidad de aproximadamente 85%) (de Souza et al., 2011).
Albert MS, DeKosky ST, Dickson D, Dubois B, et al. The diagnosis of mild cognitive impairment due to Alzheimer’s disease: Recommendations from the National Institute on Aging and Alzheimer’s Association workgroup. Alzheimers Dement. 2011; 7(3): 270-9.
Álvarez-Linera Pradoa J, Jiménez-Huete A. Neuroimagen en demencia. Correlación clínico-radiológica. Radiología 2019; 61(1): 66-81.
Blennow K, Hampel H. CSF markers for incipient Alzheimer’s disease. Lancet Neurol 2003;2(10):605-613.
Blennow K, Hampel H, Weiner M, Zetterberg H. Cerebrospinal fluid and plasma biomarkers in Alzheimer disease. Nat Rev Neurol 2010;6(3):131-144.
Brys M, Pirraglia E, Rich K, Rolstad S, Mosconi L, Switalski R, et al. Prediction and longitudinal study of CSF biomarkers in mild cognitive impairment. Neurobiol Aging 2009;30(5): 682-690.
Camacho V, Gómez-Grande A, Sopena P, García-Solis D et al. PET amiloide en enfermedades neurodegenerativas que cursan con demencia. Rev Esp Med Nucl Imagen Mol 2018;37(6):397- 406.
De Beaman SR, Beaman PE, García-Peña C, Villa MA et al. Validation of a modified version of the Mini-Mental State Examination (MMSE) in Spanish. Aging neuropsychology and Cognition 2004:11(1);1-11.
De Souza LC, Lamari F, Belliard S, Jardel C, Houillier C, De Paz R, et al. Cerebrospinal fluid biomarkers in the differential diagnosis of Alzheimer’s disease from other cortical dementias. J Neurol Neurosurg Psychiatry 2011;82(3):240-246.
Dubois B, Feldman HH, Jacova C, et al. Research criteria for the diagnosis of Alzheimer ́s disease: revising the NINCDS-ADRDA criteria. Lancet Neurol. 2007; 6: 734-746.
Dubois B, Feldman HH, Jacova C, Hampel H, Molinuevo JL, et al. Advancing research diagnostic criteria for Alzheimer’s disease: the IWG-2 criteria. Lancet Neurol. 2014; 13: 614-629.
Franco-Macías E, Rodrigo-Herrero S, Luque-Tirado A, Méndez-Barrio C, Medina-Rodriguez M, Graciani-Cantisán E, Sánchez-Arjona MB, Maillet D. Reliability and Feasibility of the Memory Associative Test TMA-93. J Alzheimers Dis Rep 2020: 24;4(1):431-440.
Grande G, Vanacore N, Vetrano DL, Cova I et al. Free and cued selective reminding test predicts progression to Alzheimer’s disease in people with mild cognitive impairment. Neurol Sci 2018;39:1867-1875.
Hamalainen A, Tervo S, Grau-Olivares M, Niskanen E, Pennanen C, Huuskonen J, et al. Voxel-based morphometry to detect brain atrophy in progressive mild cognitive impairment. Neuroimage 2007;37(4):1122-1231.
Jack CR, Bennett DA, Blennow K, Carrillo MC, et al. NIA-AA Resarch Framework: Toward a biological definition of Alzheimer ́s disease. Alzheimers Dement. 2018; 14(4): 535-562.
Maillet D, Narme P, Amieva H, Matharan F, et al. The TMA-93: A new memory test for Alzheimer’s disease in illiterate and less edu- cated people. Am J Alzheimers Dis Other Dement 2017:32, 461-467.
Mattsson N, Blennow K, Zetterberg H.CSF biomarkers: pinpointing Alzheimer pathogenesis.Ann N Y Acad Sci. 2009;1180:28-35.
McKhann G, Drachman D, Folstein M, Katzman R, et al. Clinical diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s Disease. Neurology. 1984; 34:939-944.
Rice L, Bisdas S et al. The diagnostic value of FDG and Amyloid PET in Alzheimer´s disease- A systematic review. Eur J Radiol 2017;94:16-24.
Rodrigo-Herrero S, Sánchez-Benavides G, Ainz-Gómez L, Luque-Tirado A, Graciani-Cantisán E, Sánchez-Arjona MB, Maillet D, Jiménez-Hernández MD, Franco-Macías E. Norms for Testing Visual Binding Using the Memory Associative Test (TMA-93) in Older Educationally-Diverse Adults. J Alzheimers Dis 2020;75(3):871-878.
Rodrigo-Herrero S, Luque-Tirado A, Méndez-Barrio C, García-Solís D, Bernal Sánchez-Arjona M, Oropesa-Ruiz JM, Maillet D, Franco-Macías E. TMA-93 Validation by Alzheimer’s Disease Biomarkers: A Comparison with the Free and Cued Selective Reminding Test on a Biobank Sample. J Alzheimers Dis 2021;82(1):401-410.
Valotassiou V, Papatriantafyllou J, Sifakis N, Tzavara C, Tsougos I, Psimadas D, et al. Clinical evaluation of brain perfusion SPECT with Brodmann areas mapping in early diagnosis of Alzheimer’s disease. J Alzheimer’s Dis. 2015;47:773–85.
Scheltens P, Fox N, Barkhof F, De Carli C. Structural magnetic resonance imaging in the practical assessment of dementia: beyond exclusion. Lancet Neurol 2002;1(1):13-21.