AVANCES EN TRATAMIENTOS MODIFICADORES DE LA ENFERMEDAD DE ALZHEIMER
Hoy en día se dispone de cuatro fármacos o principios activos, con indicación específica para el tratamiento de la enfermedad de Alzheimer. Tres de ellos pertenecen al grupo de de los inhibidores de la Acetil – Colinesterasa y el cuarto es un antagonista del receptor NMDA.
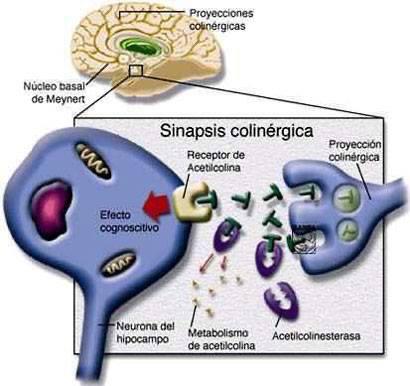
Una de las causas que conducen a la Enfermedad de Alzheimer es la disminución de los niveles de acetilcolina, en parte debido a una mayor actividad de la enzima acetilcolinesterasa, responsable de su degradación. Por este motivo se han desarrollado a lo largo de los años muchos inhibidores de la acetilcolinesterasa, tanto naturales como sintéticos.
Los inhibidores reversibles de la Acetilcolinesterasa bloquean la actividad de la enzima manteniendo la disponibilidad cerebral de la acetilcolina y, por lo tanto, pueden compensar la muerte celular.
También pueden conducir a la mejora de algunos síntomas cognitivos (memoria, atención) y conductuales (apatía, agitación, alucinaciones) durante la fase leve de la enfermedad. No obstante, estos beneficios suelen ser discretos y pocos pacientes responden a la terapia. Esta baja respuesta probablemente se deba a la alteración en la barrera hematoencefálica en pacientes con EA, que reduce
la permeabilidad de este tipo de fármacos.
Generalmente son fármacos bien tolerados, con pocos efectos secundarios. Los más comunes son náuseas y, en algunos casos, arritmia cardíaca.
Los utilizados en nuestro medio, aprobados tanto por la Administración de Alimentos y Medicamentos como por la Agencia Europea de Medicamentos son:
- Donepezilo
- Se administra durante el primer mes de tratamiento a una dosis diaria de 5 mg, que luego se puede aumentar hasta 10mg.
- Las reacciones adversas observadas con más frecuencia incluyen diarrea, calambres musculares y fatiga.
- Rivastigmina
- Es un inhibidor no competitivo y pseudo-irreversible. Se utiliza en EA de leve a moderada.
o La administración suele ser a una dosis diaria inicial de 3 mg que se puede aumentar hasta 4 veces en presentación oral y a dosis de 4,6 mg/día en parches, que se pueden aumentar hasta 9,5 mg tras las primeras 4 semanas de tratamiento. - Las reacciones adversas más frecuentes son náuseas, vómitos y, con menos frecuencia, diarrea. Por tales razones, la vía de administración es a menudo transdérmica por parches. En esta posología no es infrecuente encontrar reacciones adversas locales.
- Es un inhibidor no competitivo y pseudo-irreversible. Se utiliza en EA de leve a moderada.
- Galantamina
- o Inhibidor competitivo, rápidamente reversible y potente de la Acetilcolinesterasa.
- Se utiliza a una dosis entre 16 y 24 mg/día.
o Las reacciones adversas observadas con más frecuencia incluyen náuseas, vómitos, diarrea, dolor gástrico, astenia e insomnio.
La memantina pertenece a un grupo de fármacos del grupo de los antagonistas del receptor NMDA (por sus siglas de N-metil-D-aspartato). La memantina suele formar parte del tratamiento de la enfermedad de Alzheimer en fases moderadas o graves, sola o en combinación con algún inhibidor de la Acetil-colinesterasa. En general es una medicación bien tolerada, pero algunas personas pueden experimentar efectos secundarios como alucinaciones, confusión, mareo, dolor de cabeza o estreñimiento. Si aparecen, estos efectos suelen ser leves y tienden a desaparecer en cuestión de días o un par de semanas.
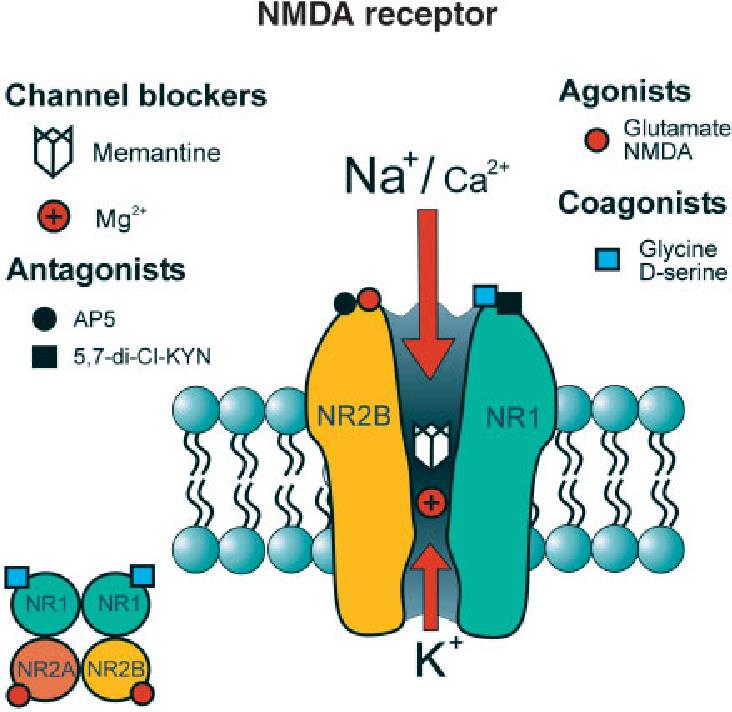
La memantina se produce tanto en solución oral como en comprimidos. Se suele iniciar con aumento de dosis de forma progresiva hasta un objetivo de 20mg al día.
La Enfermedad de Alzheimer, a día de hoy, no tiene cura. Actualmente hay más de 40 millones de personas en el mundo que padecen la enfermedad y en 2050 se estima que la prevalencia mundial será de unos 150 millones de personas. Una verdadera pandemia. Sin embargo, la investigación al respecto claramente no es suficiente. En España por ejemplo, se invierte el doble en investigación de caída del cabello que en Alzheimer. A nivel global encontramos una publicación científica sobre enfermedades neurodegenerativas frente a 12 sobre cáncer. Y todo ello, a pesar de la prevalencia y del impacto socioeconómico de esta enfermedad.
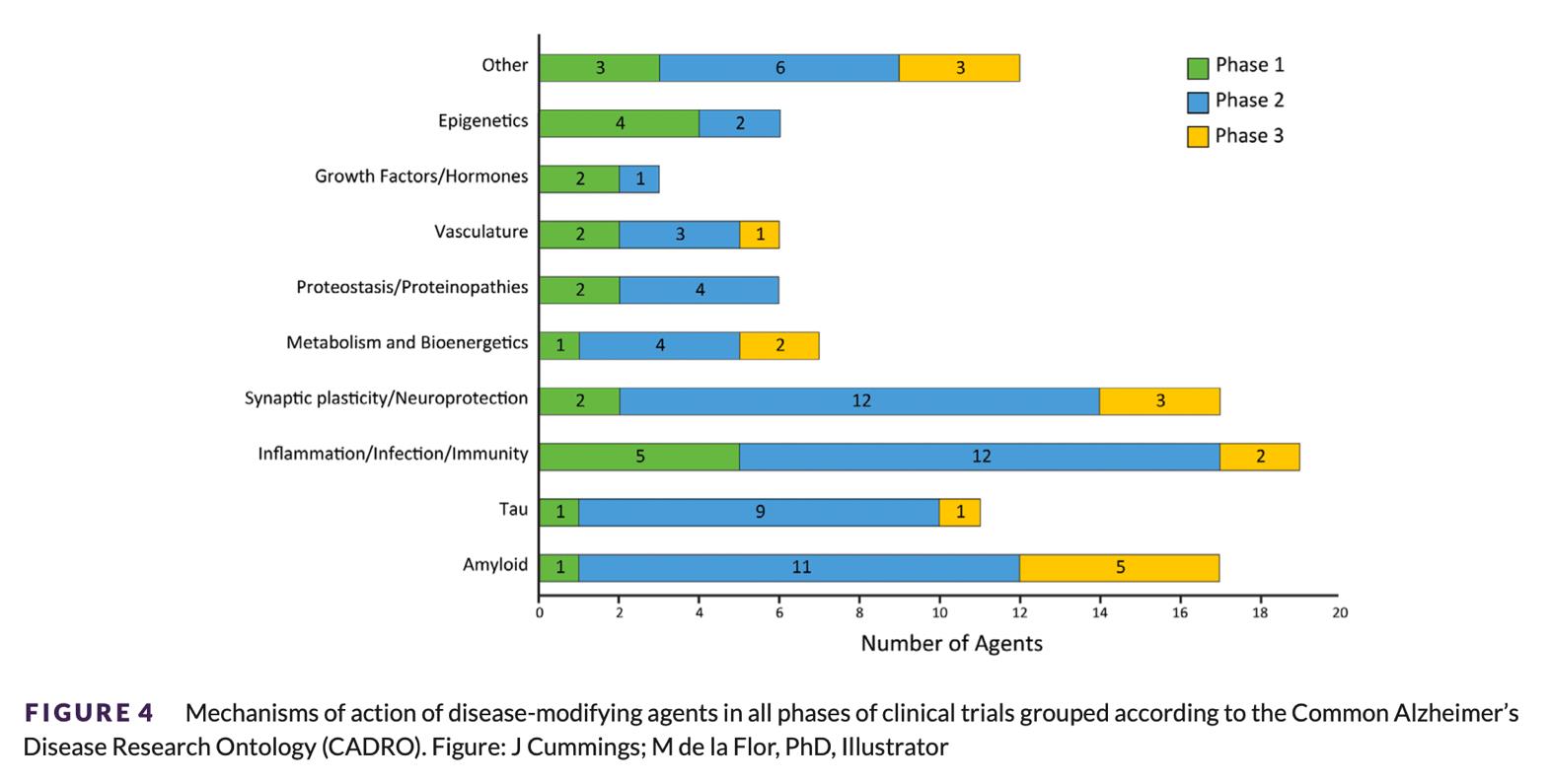
Actualmente hay más de 100 moléculas en investigación para el tratamiento de la enfermedad, algunos modificadores de la enfermedad y otros tratamientos sintomáticos. Las dianas estudiadas son:
- Amiloide (incluyendo anticuerpos monoclonales, vacunales y antiagregación)
- Plasticidad sináptica / Neuroprotección
- Inflamación / Infección / Inmunidad
- Metabolismo / Bionergética
- Tau y vascularización
Los participantes en estos ensayos se encuentran en todas las etapas de la enfermedad, desde asintomáticos hasta demencia grave. No obstante, en los últimos años se está priorizando la inclusión de pacientes en las etapas más iniciales de la enfermedad (preclínico o prodrómico).
Hasta la fecha, no se ha aprobado ningún fármaco para la Enfermedad de Alzheimer preclínica en nuestro país. No obstante, la reciente aprobación del Aducanumab por la FDA hace pensar que también estará disponible en Europa en los próximos meses.
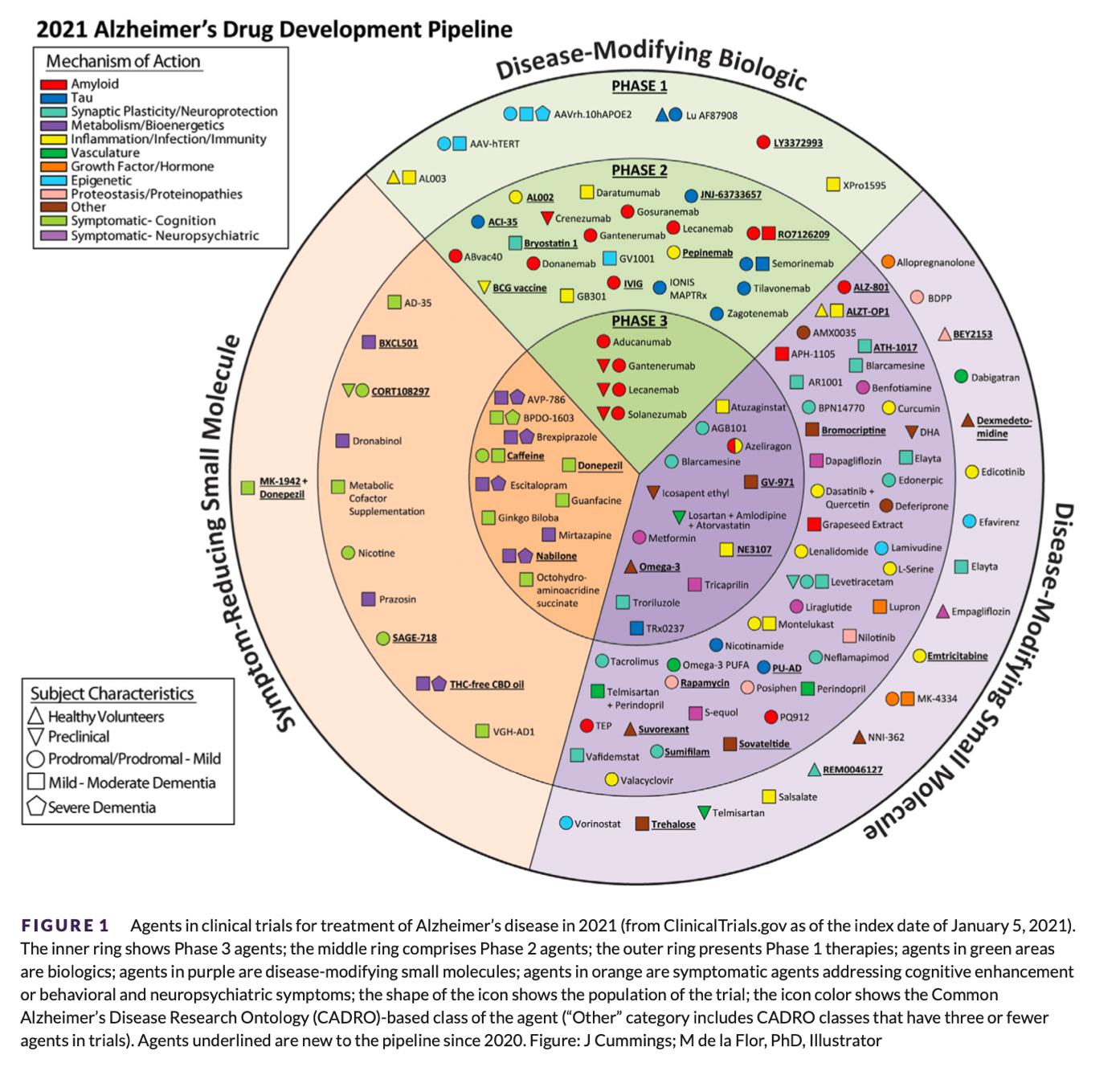
Actualmente hay 28 agentes en ensayos en fase 3: 11 agentes sintomáticos, 17 modificadores de la enfermedad.
Los bioterapéuticos de próxima generación incluyen terapias de células, genes y nucleótidos. Hay nueve ensayos de terapias celulares, un oligonucleótido dirigido a la expresión de tau y varios moduladores epigenéticos. Las tecnologías han avanzado para facilitar los ensayos de terapia génica y se anticipan ensayos en proceso. Las intervenciones con células madre pueden promover la regeneración de las células nerviosas, agregando una dimensión a la respuesta terapéutica más allá de la conseguida por los fármacos modificadores de la enfermedad según demuestran los ensayos clínicos actuales.
En junio de 2021 la Administración de Drogas y Alimentos de los EE. UU. (FDA) aprobó aducanumab para tratar a pacientes con Enfermedad de Alzheimer. El aducanumab es la primera terapia dirigida a la fisiopatología subyacente de la Enfermedad de Alzheimer. El aducanumab es un anticuerpo monoclonal humano que puede interactuar selectivamente con los agregados de Aβ, incluidos los oligómeros solubles y las fibrillas insolubles.
Los ensayos clínicos en fase 3 realizados con este fármaco fueron ENGAGE y EMERGE, finalizaron en marzo de 2019. Únicamente mostraron resultados con beneficios clínicos en estudios post-hoc, lo que llevó a un rechazo de la primera solicitud para la aprobación del fármaco en noviembre de 2020. Fue finalmente aprobado de forma acelerada este pasado mes de junio de 2021. Como parte de la aprobación acelerada, Biogen llevará a cabo un ensayo controlado para verificar los beneficios clínicos del aducanumab.
Es esperable que en los próximos meses también se apruebe el fármaco en Europa, para pacientes con biomarcadores positivos para Enfermedad de Alzheimer y en fases preclínicas o prodrómicas.
Se estima que retrasar el inicio de la Enfermedad de Alzheimer en solo cinco años reduce el costo y la prevalencia de la enfermedad a la mitad. Aunque aún no tenemos cura para esta enfermedad, las opciones de estilo de vida, incluida la dieta, se están viendo como una terapia complementaria viable para reducir el deterioro cognitivo.
Las dietas mediterráneas tienen mecanismos biológicos que apoyan sus beneficios neuroprotectores potenciales, pero los resultados de los resultados del estudio sobre estos beneficios han sido inconsistentes. La ingesta dietética de antioxidantes, vitaminas B, polifenoles y ácidos grasos poliinsaturados puede ayudar en la reducción del riesgo de padecer Enfermedad de Alzheimer o retrasar su aparición. Estos nutrientes inhiben la formación de oligómeros y fibras de péptidos beta- amiloides. Las grasas monoinsaturadas desempeñan un papel importante en la inducción de la autofagia, un déficit que se asocia con la EA en estadio temprano. La autofagia contribuye a la generación y metabolismo del beta-amiloide y al ensamblaje de tau, por lo que su mal funcionamiento puede conducir a la progresión de la enfermedad.
Se ha demostrado que el ácido docosahexaenoico (DHA), que se encuentra en pescados grasos como el salmón, reduce los niveles de proteína tau en modelos animales y aumenta una proteína específica, LR11, que es importante para la salud cerebral. Un déficit de LR11 se asocia con un aumento de la producción de beta-amiloide. El DHA también es un componente clave de los lípidos cerebrales, y una ingesta adecuada puede ayudar a mantener la integridad y la función neuronal.
Según Janssen et al. en una revisión sistemática de 2010, dosis de 240mg al día demostraban mejorar la capacidad de vida diaria en los pacientes y podrían ralentizar el deterioro cognitivo. Esto llevó a su recomendación por parte de la Sociedad Española de Neurología. Sin embargo, estudios más recientes con preparaciones de Ginkgo biloba tienen resultados más discretos. Algunos demuestran un efecto beneficioso en los primeros 6 meses de tratamiento, aunque otros no parecen encontrar claras diferencias respecto al placebo.
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)
- Centro de Referencia Estatal de Alzheimer de Salamanca. IMSERSO
- Confederación Española de Alzheimer (CEAFA)
- Cummings. J, Lee. G, Zong. K, Fonseca. J, Taghva. K (2021) Alzheimer’s disease drug development pipeline: 2021. Alzheimer’s Dement. 25; 7: 7e12179.
- Duplantier. SC, Gardner. CD (2021) A Critical Review of the Study of Neuroprotective Diets to Reduce Cognitive Decline. Nutrients 13(7): 2264
- Guías diagnósticas y terapéuticas de la Sociedad Española de Neurología. (2018). Coordinators Sagrario Manzano. M, Fortea.J, Villarejo.A and Sánchez del Valle.R. Ed. Luzan 5. ISBN: 978-84- 17372-34-7. PP.11-72
- Janssen. IM, Sturtz. S, Skipka. G, Zentner. A, Velasco Garrido. M, Busse.R (2010) Ginkgo biloba in Alzheimer’s disease: a systematic review. Wien Med Wochensch 160(21-22):539-546.
- Ji. C, Sigurdsson. EM (2021) Current Status of Clinical Trial son Tau Inmmunotherapies. Drugs 81 (10): 1135 – 1152.
- Liao. Z, Cheng. L, Xiaoxue. L, Zhang. M, Wang. S, Huo. R (2020) Meta-analysis of Ginkgo biloba Preparation for the Treatment of Alzheimer’s Disease. Clin Neuropharmacology 43 (4): 93-99.
- Parums. DV (2021) Editorial: Targets for Disease – Modifying Therapies in Alzheimer’s Disease, Including Amyloid β and Tau Protein. Med Sci Monit 27:e934077.
- Vecchio I, Sorrentino.L, Paoletti.A, Marra.R, Arbitrio. M (2021) The State of The Art on Acetylcholinesterase Inhibitors in the Treatment of Alzheimer’s Disease. J Cent Nerv Syst Dis. 7; 13.
- Yang. P, Sun. F (2021) Aducanumab: The first taargeted Alzheimer’s therapy. Drug Discov Ther. 15(3): 166-168.